Für die Qualität und Sicherheit von In-vitro-Medizinprodukten hat die EU mit der IVDR (In-vitro-Diagnostika Verordnung) einen neuen Rechtsrahmen geschaffen, der ab Mai 2022 für alle Mitgliedsstaaten rechtsverbindlich höhere Standards setzt. Die Verordnung verbessert vor allem die klinische Sicherheit von In-vitro-Diagnostika und bildet eine einheitliche Rechtsgrundlage für alle Hersteller.
Kernpunkte der Neuregelung sind verschärfte Anforderungen an Dokumentation, klinische Nachweise und Konformitätsbewertung sowie die Transparenz und Rückverfolgbarkeit nach Inverkehrbringen der Produkte. Hersteller zeigen mit der Zertifizierung, dass sie höchste Qualitäts- und Sicherheitsstandards erfüllen und über ein effektives Risikomanagement verfügen.
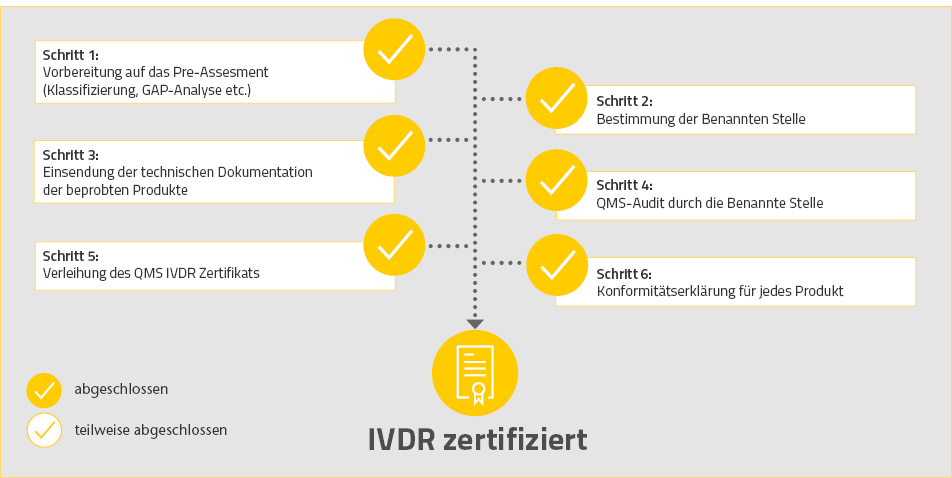
Mit seinem seit jeher hohen Qualitätsanspruch bekennt sich R-Biopharm zu 100 Prozent zu den IVDR-Bestimmungen und verfolgt unter Aufbringung erheblicher Ressourcen ihre vollständige Umsetzung. Mit unserem ganzheitlichen Qualitätsmanagementsystem sorgen wir dafür, dass von der Entwicklung bis zur Anwendung der Produkte die normativen und regulatorischen Anforderungen eingehalten werden und entsprechend hohe Qualitätsstandards gelten. Damit stellen wir sicher, Qualität kontinuierlich zu verbessern, um dauerhaft verlässliche und qualitativ hochwertige Produkte für die Gesundheit von Verbrauchern und Patienten zu liefern.
Mit seinem Zukunftswillen, der zu den Grundwerten des Unternehmens gehört, steht R-Biopharm zu diesem Bekenntnis. Zwar wurden die Übergangsfristen verlängert – Produkt-Innovationen müssen ab 26. Mai 2022 den neuen Regularien entsprechen, während das für Bestandsprodukte unterschiedlicher Klassen erst ab Ende Mai der Jahre 2025 (für Klasse-D-Produkte), 2026 (Klasse C) und 2027 (Klassen A Steril und B) gilt. Ungeachtet dieser Tatsache hat die Umsetzung der IVDR-Anforderungen weiterhin bei R-Biopharm höchste Priorität.
Durch die IVDR aufkommende Änderungen an unseren Produkten
Um unsere Bestandsprodukte von einer IVDD- auf eine IVDR-CE-Kennzeichnung umzustellen, werden eine Reihe allgemeiner Änderungen an den Produktetiketten und Produktinformationen (Gebrauchsanweisung / Bedienungsanleitung) vorgenommen, sodass sie den aktuellsten Formaten entsprechen, die von unseren benannten Stellen genehmigt wurden.
Für diese Produkte bleiben Zusammensetzung, Leistung und Verwendungszweck identisch. Während des Übergangs der Produkte von der IVDD zur IVDR werden nur das Produktetikett und die Produktinformationen geändert, wie in den folgenden Absätzen beschrieben.
Änderungen am Produktetikett umfassen:
- Für sterile Produkte der Klasse A, Klasse B, C und D folgt der CE-Kennzeichnung eine vierstellige Nummer.
- Ausnahme: Selbst deklarierte Produkte der Klasse A zeigen weiterhin die CE-Kennzeichnung ohne die vierstellige Nummer.
- Die vierstellige Nummer gibt die benannte Stelle an, die das Produkt nach IVDR zertifiziert hat. Für R-Biopharm Produkte lautet die Nummer der benannten Stelle 0123 für TÜV SÜD, Deutschland.
- Die UDI (Unique Device Identifier) im 2D-Data-Matrix-Code-Format und in menschenlesbarer Form.
- Für (rechtliche) Hersteller, die nicht in einem der EU-Mitgliedstaaten ansässig sind, wird die Importeur-Information zu der bereits vorhandenen Information der Bevollmächtigten (EC REP) hinzugefügt.
Im Anschluss finden Sie je ein Beispiel für unsere Etiketten nach IVDD (Bild 1) und nach IVDR (Bild 2).
Änderungen an Produktinformation umfassen:
- Die CE-Kennzeichnung, gefolgt von einer vierstelligen Zahl (für sterile Produkte der Klasse A, Klasse B, C und D). Die vierstellige Nummer gibt die benannte Stelle an, die das Produkt nach IVDR zertifiziert hat Für R-Biopharm Produkte lautet die Nummer der benannten Stelle 0123 für TÜV SÜD, Deutschland. Selbst deklarierte Produkte der Klasse A zeigen weiterhin die CE-Kennzeichnung ohne die vierstellige Nummer.
- Eine Erklärung in Bezug auf die Meldung von “Schweren Vorfällen”.
- Eine Information zur Verfügbarkeit des Kurzberichts über Sicherheit und Leistung (SSP) bei Klasse C und D Produkten.
Im Anschluss finden Sie je ein Beispiel für unsere Produktinformationen nach IVDD (Bild 1) und nach IVDR (Bild 2).















